前言
歐盟當(dāng)?shù)貢r間7月17日,歐盟發(fā)布《給非歐盟/歐洲經(jīng)濟(jì)區(qū)國家當(dāng)局醫(yī)療器械和體外診斷醫(yī)療器械的情況說明》《Factsheet for authorities in non-EU/EEA states on medical devices and in vitro diagnostic medical devices》。

原文下載鏈接:
https://health.ec.europa.eu/system/files/2023-07/thirdcountries_factsheet_en_0.pdf
該情況說明標(biāo)題定義的對象非常明確---for authorities in non-EU/EEA states---給非歐盟/歐洲經(jīng)濟(jì)區(qū)國家當(dāng)局,也是因?yàn)榻鼉赡隁W盟新法規(guī)推進(jìn)進(jìn)展比較緩慢,原持有MDD轉(zhuǎn)換成MDR證書的廠家占比也不大,加之在今年3月20日,歐盟官方 Official Journal 正式發(fā)布了 Regulation (EU) 2023/607修改MDR過渡期條款法規(guī),可參見往期推文:
所以該情況說明是給非歐盟/歐洲經(jīng)濟(jì)區(qū)國家當(dāng)局的情況說明和梳理,因?yàn)橛质切路ㄒ?guī),又是延期法案,廠家外貿(mào)團(tuán)隊在非歐盟/歐洲經(jīng)濟(jì)區(qū)國家做當(dāng)?shù)刈詴r,當(dāng)?shù)氐乃幈O(jiān)當(dāng)局可能會面臨困惑和混淆,比方說:
某些國家是認(rèn)可CE證書做當(dāng)?shù)刈缘模热缯f澳大利亞,廠家持具已經(jīng)過期了的MDD證書去注冊,那么根據(jù)延期法規(guī):
2021年5月26日之后至2023年3月20日之間到期的MDD證書:
在證書沒有被公告機(jī)構(gòu)吊銷的前提下,需要滿足下列條件之一 (注意:是滿足兩個條件之一,而非兩條都要滿足),可以延期 :
1)必須已經(jīng)跟公告機(jī)構(gòu)簽署了MDR的認(rèn)證合同,不能僅僅是提交了認(rèn)證申請。
2) 歐盟成員國的主管當(dāng)局根據(jù)MDR第59(1)條的規(guī)定,對適用的合格評定程序給予豁免,或根據(jù)MDR第97(1)條的規(guī)定,要求制造商進(jìn)行適用的合格評定程序。
那么,如果非歐盟/歐洲經(jīng)濟(jì)區(qū)國家當(dāng)局在質(zhì)疑這張已經(jīng)過期的MDD證書的情況下,可以通過這個官方說明去做解釋,以保證當(dāng)?shù)刈缘恼_M(jìn)行。
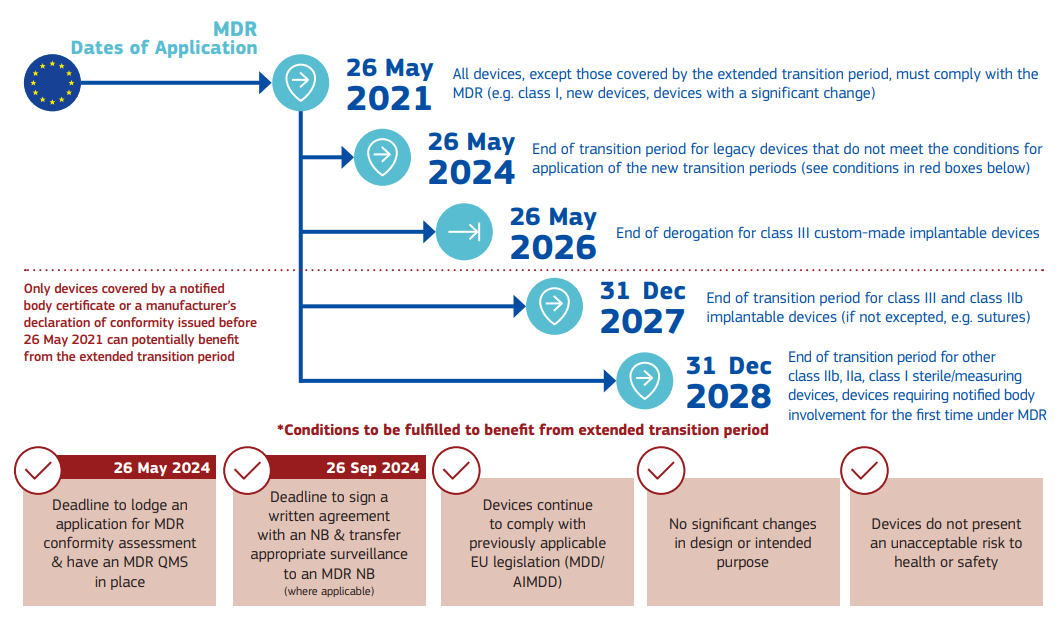
幾個關(guān)鍵時間點(diǎn)
針對MDR,該情況說明書中列明了相應(yīng)的時間點(diǎn):
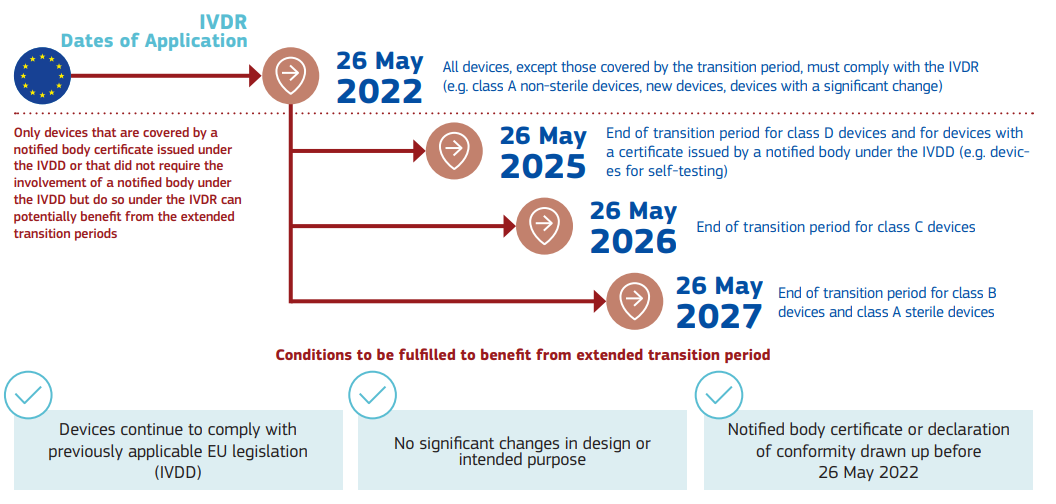
針對IVDR,該情況說明書中列明了相應(yīng)的時間點(diǎn):
結(jié)語
近兩年歐盟醫(yī)療器械新法規(guī)和延期法案頻出,廠家外貿(mào)團(tuán)隊在非歐盟/歐洲經(jīng)濟(jì)區(qū)國家做當(dāng)?shù)刈詴r,當(dāng)?shù)氐乃幈O(jiān)當(dāng)局可能會面臨困惑和混淆。
歐盟此次頒布的情況說明是在廠家外貿(mào)過程中,出口國藥監(jiān)對遞交的注冊資料的重要判斷依據(jù),為廠家在非歐盟國家進(jìn)行醫(yī)療器械產(chǎn)品提供了法規(guī)上的有利支持。
美德氏醫(yī)械服務(wù)范圍
服務(wù) | |
法規(guī)合規(guī)及產(chǎn)品注冊服務(wù)
醫(yī)療器械法規(guī)培訓(xùn)及測試,臨床實(shí)驗(yàn)服務(wù)
服務(wù) | |
MDR 2017/745/EU 法規(guī)培訓(xùn) | |